新闻中心
胶体金在快速检测中当前及未来的应用
时间:2020-08-10点击量:次
胶体金在快速检测中当前及未来的应用
James Carney, Helen Braven, Joanna Seal, and Emma Whitworth 文
Rainylily 战友 译
在过去的5年中,应用金颗粒及层析的检测法日益确立了其在床旁检测中的地位。针对不同分析物的简易层析检测法的出现简化并加速了检测体系,也对诸多企业产生重大影响。例如,可以在临床问诊过程中利用病人的一滴血液、尿液或者唾液做出精确的诊断结果,这样当病人仍在场时就可以立即开始治疗了。同样地,食品生产公司可以在食品加工的不同阶段运用质控检测而无需专门的实验室人员也无需中断生产加工过程。另外,层析检测还可应用于兽医行医、食品贮藏和环境监测等领域,而无需专门德操作设备和培训以及结果的阐释。再加上反应的快速,使得层析成为一种理想的自我检测手段。
用于制造层析检测的材质在不断改进,也伴随着试验设计的不断改善,这些进步使得更多可产生定量结果的层析检测使用量的需求有所增加。随着数十亿元全球性的体外诊断检验市场的不断增加,这些促进因素同样可以导致快速检测手段的多样化和实验室分析的便利。这篇文章讨论了这种多样化的起因,并概括了一些胶体金可适用于各种诊断应用的特性。
胶体金在层析检测中的使用
层析检测常采用两种颗粒:染色乳胶和胶体金。许多最近开发的层析检测,包括Phadia AB公司(瑞典,Uppsala)的Immunocap Rapid 快速试验和Merck KgGA公司(德国,Darmstadt)为检测食源性病原体开发的Singlepath和Duopath试验,都选用纳米金作为标记物。
颗粒大小 用于层析检测中纳米金颗粒要比胶乳颗粒小,用于检测中硝酸纤维素膜的孔径为8-10微米,可一次容纳大量纳米颗粒。这种检测形式的敏感性取决于颗粒和被分析物在沿着膜向吸附线移动时的混合程度(见图1)。而另一个重要的因素就是小颗粒在吸附线上紧密堆集从而更易识辨。
图1层析快速检测示意图
IDV制造商必须从声誉良好的供应商处购买胶体金以确保满足严格的质控标准使得颗粒的大小和尺寸均一,这些也是保持诊断产品能自由凝集及稳定储存的主要因素。胶体金是一种均质的颗粒溶液,颗粒具有均一的表面积和电荷,满足了蛋白附着的两个主要标准。
颗粒大小范围 用于层析检测的胶体金颗粒的大小范围为5-200nm。颗粒尺寸的范围使得其可应用于不同领域。较小的颗粒可应用于生命科学领域。
为了利用层析检测应用中大颗粒的强可识辨特征,颗粒的均一性是关键的。优质的胶体金颗粒必须是单分散性的、球形的,而且形状不均一的粒子数应少于5%。其他规格的胶体金会使得实验结果不佳,并造成时间和资源的浪费。而优质的胶体金每升可以产生更多的实验结果。
可辨识性 范围在20-120nm的胶体金可散发绿光因而可出现鲜红色。即使颗粒小于透射光波长由于表面等离子共振作用它仍可以发光。被散发出的可视光波长因颗粒尺寸的大小而异。
蛋白结 不同于用于胶乳中的共价结合,蛋白质如抗体是被动结合于胶体金上的。这种结合是一种相对简单的过程无需使用其他试剂。有三种常用的金颗粒结合模式存在。
标准的胶体金颗粒被一层负电离子包被着,在离子结合过程中,所有蛋白质上的正离子可以牢牢结合在颗粒的表面。当使用柠檬酸制作金颗粒时,颗粒会与氨基酸如赖氨酸结合。
具有高度疏水性的氨基酸(如酪氨酸和色氨酸)通过疏水作用结合到金等颗粒的表面。对于疏水性氨基酸含量很高的蛋白质(如免疫球蛋白)来说,疏水结合起着重要的作用,这也是结合颗粒长时间接触含有洗涤剂的缓冲液后反应性降低的原因。
金硫键是由金和硫共用一个电子对而形成的牢固连接。金微粒与蛋白内的半胱氨酸残基的连接可能是吸附于颗粒上抗体或抗原的最重要部分。因此,应避免使用硫柳汞等含硫缓冲液或防腐剂。
可调控性 经过严格的质控程序可持续生产出尺寸符合要求的均一圆形胶体金颗粒。多年的发展经验已经消除了批量生产中的变异因素及大批量供应的难题(如图2)。胶体金的连接方式简单,仅仅涉及到蛋白、稀释液及微粒而无需反应剂。根据规定的原材料,IDV生产者可以计算出每粒胶体金所需要的能做出最佳检测结果的精确的抗体数量,从而节约成本减少原材料的浪费。
图2 优质的圆形纳米金变异系数低、形态一致、具有最佳的抗体吸附力和灵敏度。
层析检测中原材料的改进 用于层析检测的原材料质量的改进已经提高了检测的性能。
颗粒 工艺上的改进可以不断生产出大量大尺寸(250nm)圆形胶体金颗粒,可作为市场上多种标记物。40nm大小的颗粒被认为是最适于层析检测的。这种大小的尺寸既足够大到易于识辨又足够小到不会对蛋白结合到胶体金表面产生空间位阻从而优化标记原材料的性能。随着颗粒尺寸的增加,其辨识性也有所增加。最初的研究表明,应用60nm的胶体金可以增加某些检测中末端信号的辨识性,从而有可能提高测试的敏感性。
硝酸纤维素膜 这种硝酸纤维素膜的一个重要特征就是其孔径的大小可以控制蛋白结合的有效表面积及样品通过测试条带的毛细管流速。劣质胶体金易于聚集,不能自由通过纤维素膜,因而胶体
图3 尺寸分布对比数据表明标记40 nm的胶体金平均直径达143nm
金颗粒的大小必须均一。IDV制造商还必须保证胶体金尺寸的规格。尺寸分布比较显示,生产粗劣的胶体金标记为40nm,可能包含不同尺寸的颗粒,其平均直径可以达到143nm,而导致错误的结果(如图3)。新型硝酸纤维素膜被制成可湿水的,不影响蛋白质吸收和测试功能。利用表面活性剂和某些阻滞剂进行产品的后期处理可提高颗粒的流动性,消除测试组份间的非特异性相互作用。
样本垫 样本垫可以被化学药品浸渍减少样品成分差异、提高检测灵敏度。去污剂、增稠剂、阻滞剂和盐通常可以经干燥后加入样本垫。此工艺可以避免使用复杂的显影/追踪缓冲液,实现真正的一步检测。
其他膜 如今的血液分离膜可以有效地分离静脉或毛细血管中未溶血的血红细胞及血浆。直流膜和测流膜均已上市,可以分离10-110ml全血样品,这样可以对血清或血浆进行直接检测而无需进行样品处理和离心。
核苷酸层析检测 层析检测法已经发展至可以用多种形式检测核苷酸。该测
图4 劣质40nm胶体金形态非圆形、
不均一、易聚集、颗粒间变异系数高
法可以检测出如聚合酶链反应(PCR)及结螺旋霉依赖性扩增等扩增技术的产物,结螺旋霉依赖性扩增是一种类似于PCR的等温扩增法,其DNA链的分离是通过酶作用而不是加热来完成。这些技术无需昂贵的设备就可以进行检测。
图5. (a)作为PCR扩增引物,检测双链PCR或tHDA产物; (b) 以固定的吸附抗体、抗体-胶体金结合物及半抗原标记的序列特异性寡核苷酸探针,检测未标记的单链核酸靶标; (c) 使用固定的寡核苷酸吸附探针和寡核苷酸结合胶体金,进行无抗体检测。
非序列特异性检测 这是一种以层析形式并应用抗体或半抗原标记的核苷酸检测核苷酸分析物的存在或缺失。应用这种检测方法,两种半抗原(DNP和生物素)通过与(固定于层析带上的)抗DNP抗体和(结合于纳米金颗粒上的)抗生物素抗体结合捕获并检测分析物。半抗原具有在高温下稳定的
优势,并且不会影响核苷酸修饰酶的活性。半抗原还可以通过商业方式获得合成的寡核苷酸。该方法适合于使用生物素和DNP标记的试剂检测双链扩增产物(如图5a)。
序列特异检测 许多分子诊断应用需要应用序列特异性检测。这种检测法可以了解核苷酸分析物的序列从而区别于其他分析物和非特异性扩增产物。通过使用寡核苷酸探针与目的序列的退火复性完成序列的特异性。有多种方法可以确保信号的产生是依赖于通过使用探针固定靶标或者通过标记纳米金的探针-靶标退火来实现(如图5b和5c)。
图6 以固定的寡核苷酸吸附探针和寡核苷酸-胶体金结合物检测多核苷酸序列。检测不同序列的固定探针在硝酸纤维素膜上形成测试条,含有各个序列的核酸物吸附在各个位置,然后以另一与胶体金结合的探针进行检测,产生一组谱线。
无抗体核苷酸层 无需抗体的检测系统可以减少成本并增加检测的重复性、灵敏度及特异性。无抗体的核苷酸层析检测系统是基于通过固定寡核苷酸探针的靶标捕获和通过直接结合到纳米金的探针的检测(如图5c)。序列特异性寡核苷酸探针可以利用斑点印记检测法原理类似的方法固定于层析条带上。捕获探针的灵敏度和特异性与使用抗体的方法相当,并且在多重分析(如在每个条带上使用多条吸附线)方面有明显的优势(如图6)。人们使用多种技术开发将核苷酸结合到纳米金的方法以得到稳定坚固的结合物。
胶体金的其他应用。胶体金在那些需要仪器辨别最终结果的快速检测中同样有效。这些检测利用的是胶体金的光散射特性。尽管20-120nm的胶体金比可见光波长小,但由于具有表面等离子共振特性其在光散射方面仍有效。表面等离子共振是特定波长的投射光和存在于纳米金中传导电子交互作用的结果。光散射的强度取决于投射光的波长和粒子的大小。这种表面等离子共振特性可以作为检测用于标记的粒子的方法而被开发。
由于其具有的表面等离子共振特性,胶体金还可用作微陈列中的荧光标记替代物。与荧光标记测定相比,利用共振光散射检测纳米金颗粒测定细菌RNA,灵敏度要高50倍。使用金颗粒还有一个优点——它不会发生光致漂白。
光散射的强度和最大波长与纳米金颗粒的大小成正相关。通过混合不同直径的胶体金颗粒,选择出不同的颗粒用于不同的分析物,将可能开发出多重检测法,若再加上对不同尺寸粒子等离子共振峰加以区分的话。这样就可以扩大应用于层析或者其他检测形式的测试范围。
纳米金颗粒的使用使得Pointcare Technologies公司(美国麻省,Marlborough)应用简化电流细胞计数原理开发出一种CD4检测法。这种开发的检测法免除了各种不同的荧光标记和错综复杂的检测衡量手段。这种CD4淋巴细胞计数法使用可特异性结合到这些淋巴细胞表面的胶体金抗CD4抗体结合物,它可以在特定的方向散发出光从而区别于其他类型的细胞,例如表达CD4的单核细胞。这种简易、小巧、轻便的细胞计数设备还可以计数白细胞和淋巴细胞,它还可以用来监测HIV 和AIDS病人的疗效。
胶体金在光散射诊断中的应用
人们对开发涉及到胶体金和纳米银的其他光散射技术一直有着浓厚的兴趣,表面强化拉曼光谱技术(SERS)中的目前已应用于多种领域,纳米金在SERS检测方面的应用也日益广泛尤其是在生物分析领域。
拉曼光谱技术(SERS)方法 拉曼散射指的是对投射光在不同波长处的光散射。由于每一种物质都有其独特的拉曼光谱,使得SERS成为一项极好的鉴别工具。
然而,拉曼信号也有其特有的弱点:约107个入射光子中就有1个在出现散射时波长偏差。这些信号可以通过两种方式来增强。其中一种方法是共振拉曼散射,即将激光调至检测物质的吸收波长;另一种方法就是SERS,它要求检测物质紧密靠近金属(金或银纳米颗粒)的表面,等离子共振特性可使信号增强放大至105–106倍。将两种方法融合后即称作表面强化共振拉曼散射技术(surface-enhanced resonance Raman scattering),它是一种十分灵敏的技术,可将信号放大1014倍,并能够进行单个分子的检测。
应用纳米金属作为SERS基质 胶体金和纳米银的光学特性使得它们成为SERS检测的良好表面和基质。纳米金属适于液相检测,并且在现有的多种生物检测领域应用广泛。颗粒的大小、形态、间隙等因素对信号的增强非常关键,因而必须使用优质颗粒。开发一种稳定的检测系统依赖于优质纳米颗粒生产出的能与生物分子相互作用的稳定产物。生产出球形颗粒的替代物(如三角形或杆状)与未来SERS的应用密切相关,并有利于其应用。
SERS标签 尽管SERS可用于无
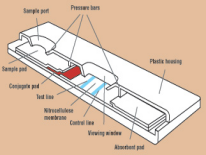
图7.在免疫夹心测定法中通过检测结合在金属纳米颗粒上的SERS活性标记物运用SERS方法
标签检测,但某些情况下,也需要在检测系统中引入一个SERS活性标记或报告基团,从而产生出强大的、易于检测的特征性拉曼信号。每个样本可以检测不同的标记物,而且SERS光谱特征在多重分析方面比荧光技术潜能更大,该标记可以只需将部分纳米颗粒。例如Nanoplex Technologies公司(美国加州,Mountain View)生产的SERS纳米标记物,包括一个包被着一层SERS活性标记分子和玻璃的金属纳米颗粒。这些颗粒可以代替传统的基于颗粒的检测以及具有金属标记复合物的定量SERS检测,用于联合
SERS检测和免疫测定形式的诊断领域(如图7)。
均相测定。类似于SERS的检测方法也可以应用于分子诊断领域。由于核酸可以用多种可购买到的荧光基团标记,这种标记无需被引入为纳米颗粒的一部分,但相反却可以用来标记核酸分析物。例如,将一个寡核苷酸吸附探针固定于金属表面,与标记的靶DNA一起退火反应,将染料引至金属表面,造成荧光淬灭、产生SERS信号(如图8)。此外,
图8 SERS法检测荧光标记的核甘酸退火靶标通过巯基基团结合到金属的表面
应用结合纳米基质和染料标记的分析物具有均相检测形式的优势。通过控制胶体银的凝集,以氨基酸基团和荧光基团修饰的核苷酸已被应用于DNA的定量检测。通过扩增阻碍突变系统等位基因特异PCR多重检测,明确样本的基因类型,尤其具有临床诊断价值。
结论
由于其能满足快速检测中灵敏度、稳定性、可靠性的增加需求,优质的成品胶体金依然是快速检测发展和生产中的常用标记。胶体金的尺寸范围使得其在多种领域中具有广泛的用途。如果生产得当,它可以带来精确、稳定的结果,产生成本效益和可靠的快速检测。可运用多种方法来开发胶体金在快速检测中的应用,甚至可以加速新的应用领域的开发。由于市场对更加精密和使用简易的快速检测法的需求,加上诊断工具需要和特定治疗相配合,因此胶体金的多功能性将有助于促进未来快速测定的开发。
展望未来,随着目前基质开发和新的标记物的设计合成等领域研究的深入SERS作为一种检测手段将受到更多的关注。同时,与此相匹配的仪器设备的发展将会增加其在诊断领域的实用性。金纳米颗粒在SERS这个新的应用领域中会发挥更大的作用。

